臨床化学編
一般検査編 (1)・(2)・(3)・(4)|血液形態編|臨床化学編|臨床免疫編 (1)・(2)|微生物編 (1)・(2)|クオリティ・マネジメント編
―臨床検査専門医および臨床検査専門医を目指す方のための、画像を中心としたクイズ形式のセミナーです。
- 出題と解答:日本臨床検査専門医会 教育研修委員会
- 各設問の位置で右スクロールするとそれぞれの解答が見られます。
- 動作確認しているブラウザはMacintosh版Netscape 4.04 および Macintosh版Internet Explorer 4.0 だけです。うまく表示されない方はホームページ編集室までご連絡ください。
設問番号:CH0011
[問題]アイソザイムとは何か説明せよ。
[解答欄]
模範解答:CH0011
[問題]アイソザイムとは何か説明せよ。
[解答]アイソザイムはMarkert & Mollerにより提唱された概念であり、"同一個体内に存在する酵素で、同一反応を触媒するが、蛋白質としては異なる分子のもの"と定義されている。すなわち、触媒作用は同じであるが、分子構造、物理化学的性状の異なった一群の酵素のことである。狭義的には異なった遺伝子座から生じた2種のサブユニットの組み合わせにより生じた酵素群であるが、臨床的には電気泳動上で2種以上の活性帯と認識された場合には、これらをアイソザイムとして取り扱っている(厳密には"酵素の多様性(Multiple Forms of Enzymes)"として区別する諸家もいる)。このため、定義のような同一遺伝子産物のうちで翻訳後修飾を受けた酵素類もアイソザイムと呼んでいる。
設問番号:CH0021
[問題] アイソザイムの存在理由は何か。
[解答欄]
模範解答:CH0021
[問題]アイソザイムの存在理由は何か。
[解答]生体内に数種のアイソザイムが存在する理由ははっきりしないが、そのアイソザイムの存在する組織もしくは細胞内での酵素活性を発揮するのに適した形の酵素が必要なためと一般的に考えられている。すなわち、例えば乳酸脱水素酵素(LDH)には5つのアイソザイムが知られているが、LDH1(H4)は心筋に、LDH5(M4)は肝臓に多量に存在している。これは、心臓のように持続的な活動を電子伝達系のATP産生に依存している臓器では、ピルビン酸をLDHにより還元して乳酸とするではなく、好気的条件下でピルビン酸をTCA回路に導き、多くのATPを産生させエネルギー源とする方がよい。そして、このためにはピルビン酸で活性が阻害され易いLDH1が合理的である。一方、骨格筋のように嫌気的条件下での解糖系にエネルギー源を依存している組織ではピルビン酸濃度が多少多くても触媒作用を示すLDH5の存在が合目的で都合がよい。 このように、生体内の組織・細胞は生体の恒常性を維持し、生命活動をするのに最適な条件を持っており、この条件は組織・細胞により異なる。このため、1種類の条件下でしか働かない酵素ではこれらに対応できず、スムースな生命活動維持のためには異なる条件下でも十分働くように、数種のアイソザイムが必要となる。
設問番号:CH0031
[問題]アイソザイム分析法の種類とその特徴(利点・欠点)を述べよ。
[解答欄]
模範解答:CH0031
[問題]アイソザイム分析法の種類とその特徴(利点・欠点)を述べよ。
[解答]アイソザイムが表1に示すようないろいろな方法で分析されている。これらのうちで、日常的に使用されているのが電気泳動法と免疫化学的方法である。
表1 主なアイソザイム分析法
1.電気泳動法
2.イオン交換カラム法
3.免疫化学法
1)免疫阻害法
2)免疫沈殿法
4.RIA、EIA
1)電気泳動法
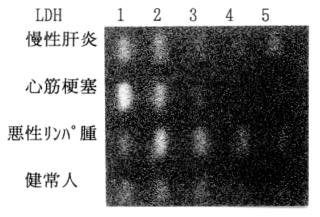
アイソザイムの各分画が異なった等電点(pI)を持ち、電気的易動度が異なることを利用して分画する方法である。例えば、乳酸脱水素酵素(LDH)は、MとHの2つからなる4量体であり、5つのアイソザイムの存在が知られている。これらのアイソザイムの等電点はM4:9.5、M3H1:8.2、M2H2:7.0、M1H3:5.8、そしてH4:4.5である。このため、寒天、アガロースなどの支持体で電気泳動すると図1に示したようにM4は最も陰極にH4は最も陽極に移動し、他の3アイソザイムもそれぞれのpIに従い泳動される。電気泳動上の分画の命名法では、陽極側から1、2、3…とされるため、H4はLDH1、M4はLDH5となる。この電気泳動法は、アイソザイムの各分画をパターンとして観察できるので、異常なアイソザイム分画、易動度の微妙な変化が検出できる利点をもつ半面、特殊機器を必要とし、操作がわりと煩雑で、分析時間が長いなどの欠点がある。
図1 LDHアイソザイムパターン
2)免疫阻害法
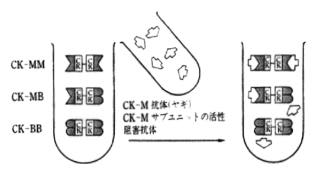
特異抗体により特定のアイソザイムの活性だけを阻害し、残存する活性を測定してアイソザイム分析を行うものである。例えば、クレアチンキナーゼ(CK)は、MとBの2つのサブユニットからなる2量体であり、CK-MM(CK3)、CK-MB(CK2)、およびCK-BB(CK1;CKの場合にはアイソザイム数が少なく、臓器の由来も推定できるため、CK1、CK2、CK3の命名よりCK-MM、CK-MB、CK-BBが一般的)の3つのアイソザイムが知られている。このCKのアイソザイム分析法として、CK-Mサブユニットに対する特異阻害抗体によりCK-Mサブユニット活性を阻害し、残存するCK-Bサブユニット活性を測定し、なおかつCK-BB活性が血清中にはほとんど検出されないことから、残存活性を2倍してCK-MB活性としている(図2)。
図2 免疫阻害法の原理
この免疫阻害法は、通常の総活性と同様な手順で、簡単かつ迅速な分析が可能であるため、緊急検査としてのアイソザイム分析には適しており、CKの他、アミラーゼのアイソザイム分析法が開発され日常的に使用され始めている。
3)RIA、EIA
電気泳動法、免疫阻害法ともに酵素活性としてアイソザイム分析を行っているが、このRIA、EIAは酵素を蛋白量として検出する方法である。非常に失活しやすい酵素、あるいは他の方法では分離が良好でない酵素のアイソザイムに用いられている。前者の代表が酸性ホスファターゼであり、後者としてはアルカリ性ホスファターゼ(ALP)の胎盤由来あるいは腫瘍由来アイソザイム分画の検出が用いられている。この方法は用いる抗体の特異性が重要であり、良否によりアイソザイム分画がまったく異なる。
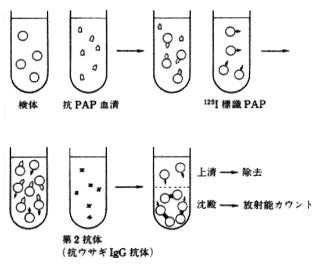
図3に日常検査として最初に導入された前立腺酸性ホスファターゼ(PAP)の測定原理を示した。本法では硫酸アンモニウムによる塩析やカラムクロマトグラフィにより高純度に精製したPAPを家兎に免疫して作成した特異抗体を利用している。まず、検体中のPAPと特異抗PAP抗体との複合体を形成させる続いて125Iを標識したPAPと検体中のPAPを競合させ、抗ウサギIgG抗体でB/F(bound/free)分離を行い、沈澱中の125Iを測定する。そして、同様にして求めた標準曲線からPAP濃度を測定する。
図3 前立腺酸性ホスファターゼRIA法の原理
4)イオン交換カラム法:
電気泳動法と同様にアイソザイムの各分画が異なる等電点(pI)をもち、しかもこれらのpIがかけ離れている時に有用な分析法である。日常検査としてはクレアチンキナーゼ(CK)のアイソザイム分析に利用されている。陰イオン交換樹脂(DEAEセファロースCL-6BまたはDEAEセファデックスA-50)をあらかじめ一定のpHおよび塩濃度で平衡化させ、検体を添加して溶出液中の塩濃度を高めていくと、最初にイオン樹脂と結合していない最もpIが塩基側のCK-MMが溶出される。さらに塩濃度を高めるとCK-MBが、そしてさらに塩濃度を高めるとCK-BB分画が溶出する。そして溶出した分画中のCK活性を測定してCKアイソザイム分析を行う。本法は簡便性の点では優れているが、溶出液による酵素の希釈、イオン交換樹脂のアイソザイム分離能などに問題が残されている。
設問番号:CH0041
[問題]乳酸脱水素酵素のアイソザイムについて述べよ。
[解答欄]
模範解答:CH0041
[問題]乳酸脱水素酵素のアイソザイムについて述べよ。
[解答]
1)LDHの概要:LDHは生体内において解糖系の最終段階に働く酵素で、L-乳酸とピルビン酸との可逆反応を触媒している。生理的状態では、ピルビン酸から乳酸産生の方向に傾いている。
2)LDHアイソザイム:LDHは分子量約140kDで、M(muscleまたはA)とH(heartまたはB)の2つのサブユニットから成る4量体であり、それらの結合様式から5つのアイソザイムが存在する。これらは電気泳動上陽極側からLDH1(H4)、LDH2(H3M1)、LDH3(H2M2)、LDH4(H1M3)およびLDH5(M4)であり、それぞれα1-グロブリン、α2-グロブリン、β-グロブリン、γ-グロブリン(LDH4、5)領域に泳動する。
3)生体内分布:LDHはほとんど全ての臓器に分布しこれら臓器・組織の障害に際しては血中に出現する。疾患に対する特異性には乏しいため、臨床的意義を高めるためにはアイソザイム分析を行う必要がある。アイソザイムの局在は表2に示すごとく比較的特異的であり、心筋にはLDH1が、肝臓にはLDH5が多量に存在し、赤血球にはLDH1-3が存在する。
表2 LDHアイソザイムの分布
| LD1(H4) | LD2(H3M1) | LD3(H2M2) | LD4(H1M3) | LD5(M4) | |
|---|---|---|---|---|---|
| (%) | (%) | (%) | (%) | (%) | |
| 血 清 | 19.5~28.5 | 27.5~34.5 | 20.0~26.0 | 9.0~14.5 | 5.5~14.0 |
| 赤血球 | 39~46 | 36~56 | 11~15 | 4~5 | 2 |
| 心 筋 | 35~70 | 28~45 | 2~16 | 0~6 | 0~5 |
| 肝 臓 | 0~8 | 2~10 | 3~33 | 6~27 | 30~85 |
| 骨格筋 | 1~10 | 4~18 | 8~38 | 9~36 | 40~97 |
4)臨床的意義:
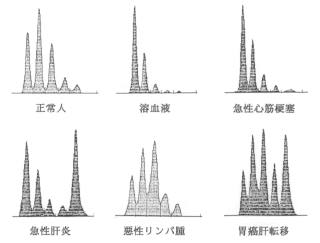
・LDH1、2が優位となる病態(多くはLDH1>LDH2):赤血球疾患(溶血性貧血、PNH、悪性貧血)、心筋梗塞、など
・LDH2、3が優位となる病態:白血病、悪性リンパ腫、筋ジストロフィ症、など
・LDH5が優位となる病態:肝炎、肝硬変、肝癌、など。(注意)肝疾患におけるLDHアイソザイム:急性肝炎ではLDH5が優位のパターンとなるが、慢性肝疾患では血中の半減期からLDH5が必ずしも優位とはならない。この時には肝逸脱酵素のAST、ALTの変動の方が鋭敏である。
・特殊なLDHアイソザイム(LDH結合免疫グロブリン):LDHに対する抗体とLDHが結合することにより巨大化したLDHが出現することがある。この場合には電気泳動で各分画が明瞭に分画されない。
5)解釈上のpit fall:
・半減期:臓器・組織によりアイソザイム組成が異なることより障害臓器を推定できるが、LDHの各アイソザイムでは半減期が異なる(LDH1は約5日、LDH5は1日)ため、病期により異なるパターンとなる。
・溶血:赤血球中には血清の約200倍のLDHが含まれ、LDH1-3分画が増加する(溶血100mg/dlで約100U/l)。
・保存:LDH4、5は冷蔵保存に対して不安定である。
設問番号:CH0051
[問題]アルカリ性ホスファターゼのアイソザイムについて述べよ。
[解答欄]
模範解答:CH0051
[問題]アルカリ性ホスファターゼのアイソザイムについて述べよ。
[解答]
1)ALPの概要:ALPはアルカリ側(pHが9.8付近)に至適活性をもつリン酸モノエステル類を加水分解する酵素である。分子量は120~160kDで、活性中心に亜鉛をもつ金属酵素である。
2)ALPアイソザイム:ALPは通常の膜電気泳動では6分画に分画される。
・ALP1:肝由来の高分子ALPで、胆管閉塞機転により胆管内圧が上昇し、胆汁中に排 泄されるべき膜結合性ALPが血中に逆流したものと考えられている。正常人血中には認められない。
・ALP2:肝由来ALPで正常人でも認められるが、胆管閉塞では著明に上昇する。
・ALP3:骨芽細胞に由来し、小児血清の主分画である。
・ALP4:胎盤に由来し、妊娠後期から上昇する。熱に対して安定であり、耐熱性ALPとも呼ばれる。
・ALP5:小腸由来であり、特に血液型のB、O型の分泌型で高値となる。
・ALP6:骨または肝由来のALPが免疫グロブリンと結合したもので、潰瘍性大腸炎での出現頻度が高い。
3)臨床的意義:
・肝疾患でのALPアイソザイム:ALP1の有無は、肝外閉塞と肝内胆汁欝滞、転移性肝癌と肝細胞性肝癌との鑑別に有用であり、いずれも前者で高率にALP1が出現する。また、ALP2は胆汁欝滞時にはビリルビンの上昇と平行して血中に増加するが、限局性肝障害(肝癌、肝膿瘍;space occupying lesion)ではビリルビンとの間に解離が認められる。ALP5は小腸由来であるが肝での代謝処理が低下する肝硬変で血中に出現・増加する。
・骨疾患:骨形成疾患(Paget病、副甲状腺機能亢進症、骨肉腫、悪性腫瘍の骨転移など)の場合には正常上限の3倍程度の上昇となる。
・悪性腫瘍:耐熱性ALP(ALP4)が腫瘍により産生されることが確認され、1968年Fishmanは患者の名前をとってReagan isozymeと命名した。同様に腫瘍産生で、ロイシンにより強く阻害される胎盤性ALPはNagao isozymeと命名された。また、早期に骨転移が認められる前立腺癌や胃癌症例の一部ではALP3の異常高値となる。
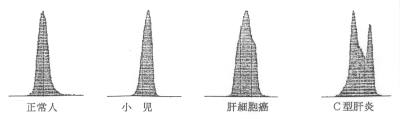
5)解釈上のpit fall:
・年齢による変動:小児期では骨性ALP(ALP3)のために成人と比較して3~5倍の高値となる(新生児期と13、14歳前後の2峰性)
・妊娠:妊娠では胎盤性ALP(ALP4)のために2~3倍の高値となる
・検体:活性中心に亜鉛、賦活剤としてマグネシウムが必要であるため、これらとキレートするEDTA塩、クエン酸Naなどを用いた血漿では活性が低下する。
・測定法:日常的に用いられているのはp-nitrophenyl phosphateを基質とするBessey -Lowry法とphenyl phosphateを基質とするKind-King(King-Armstrong)法である。これらの正常値は前者が0.3~3.0U/l、後者が3~10U/l程度である。
設問番号:CH0061
[問題]アミラーゼのアイソザイムについて述べよ。
[解答欄]
模範解答:CH0061
[問題]アミラーゼのアイソザイムについて述べよ。
[解答]
1)アミラーゼの概要:アミラーゼは澱粉、グリコ-ゲンなどの多糖類を加水分解する酵素で、ヒトに存在するのはα-1,4-結合を分解するα-アミラーゼである。
2)アミラーゼアイソザイム:ヒト体液中には膵型(P型)と唾液腺型(S型)の2種類のアイソザイムが存在する。前者は分子量54kDで糖鎖を含まないのに対して、後者は糖鎖含量の相違により分子量約62kDのfamily Aと56kDのfamily Bとに分類される。通常の電気泳動ではS型は陽極側のpre-γ位に、P型は陰極側のfast-γ位に泳動される。P型が膵臓に極めて特異的に存在するのに対して、S型は唾液腺の他に、卵巣、肺、肝、小腸にも存在する。
3)臨床的意義:
・膵疾患:急性膵炎ではP型が発症早期に上昇し、1週間程度で正常域に復する。急性膵炎診断において、血清・尿中アミラーゼは感度70~98%で、特異性は70~85%であるが、P型アミラーゼは感度100%、特異性も92%である。また、慢性膵炎では軽度上昇にとどまり、膵癌では炎症機転を続発しないかぎり上昇は認められない。
・S型の上昇:急性耳下腺炎、子宮外妊娠の破裂などで上昇する。その他、腎不全ではクリアランスの低下によりS型が上昇する
4)特殊なアイソザイム:アミラーゼ結合免疫グロブリンはマクロアミラーゼとして最初に報告されたマクロ酵素であり、血中ではアミラーゼ活性が高値であるのもかかわらず、尿中で低値の解離現象から発見された。
(参考)アミラーゼ・クレアチニンクリアランス比(ACCR):尿中アミラーゼ活性は腎機能により影響されるため、これを反映するクレアチニンとの比を算出してアミラーゼの排泄能を検査する。正常治は2.6±1.3 %であり、急性膵炎ではP型の排泄亢進により5.4±5.3%と亢進し、マクロアミラーゼでは0.2±0.1%と低下する。
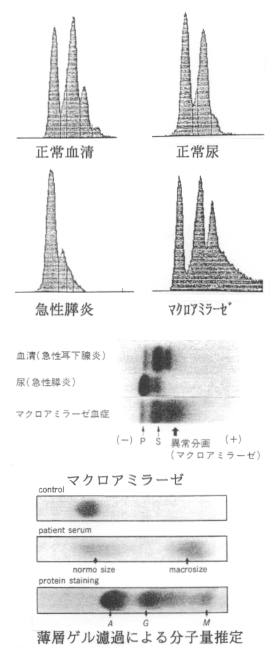
5)解釈上のpit fall:
・検体:カルシウムが活性賦活剤であるため、ヘパリン以外の脱カルシウムによる抗凝固剤では活性が低下する
・検体保存:検体を長期間保存するとデアミナーゼの作用によりアイソザイムの亜分画が出現増加する。
・分析法:電気泳動法に代わって、大量検体・迅速分析が可能な阻害剤による分析法が開発されている。1つは小麦由来インヒビターであり、もう1つがS型アミラーゼを特異的に阻害するモノクロナル抗体である。これらでは亜分画出現は関係ないが、マクロアミラーゼの検出は困難である。
設問番号:CH0071
[問題]クレアチンキナーゼのアイソザイムについて述べよ。
[解答欄]
模範解答:CH0071
[問題]クレアチンキナーゼのアイソザイムについて述べよ。
[解答]
1)CKの概要:CKはクレアチンリン酸とADPからATPとクレアチンとを可逆的に生成する転移酵素で、筋肉のエンルギー代謝上重要な役割を果たしている。
2)CKアイソザイム:CKは分子量約82kDで、M(muscle)とB(brain)の2つのサブユニットから成る2量体であり、CK-MM、-MB、および-BBの3種類のアイソザイムが存在する。CK-MMは骨格筋、心筋に、CK-MBは心筋に、そしてCK-BBは脳、平滑筋に高濃度存在している。なお、これらは細胞質上清分画に存在するCKであり、これらと細胞内局在を異にするミトコンドリアCKも存在する。
3)臨床的意義:
・心筋疾患:心筋梗塞の早期に変動し、発症後数時間で血中に上昇しはじめ16時間前後で極値となる。特にCK-MBは心筋特異性が高く、診断特異性も心電図と同様な95~100%でる。心筋炎、開心術後にも上昇する
・骨格筋疾患:進行性筋ジストロフィ症、多発性筋炎、皮膚筋炎などで上昇する
・その他:新生児やある種の悪性腫瘍(腺癌:胃癌、前立腺癌、大腸癌など)ではCK-BBが出現・増加し、悪性過高熱、Reye症候群でもCK-MB、CK-BBが認められる。
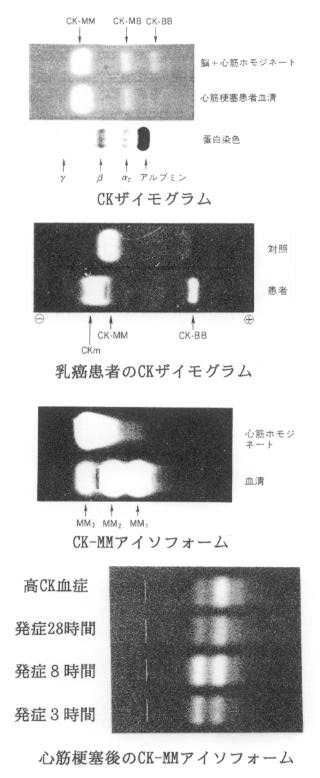
4)特殊なアイソザイム:CK結合免疫グロブリンが他の酵素と同様に認められる。また、ミトコンドリアCK(m- CK)は重症心筋梗塞や悪性腫瘍などで認められる。
5)CK-MMアイソフォーム:CK-MM、-MBにはアイソフォームが存在する。すなわち、電気泳動時間を通常より長くすると単一バンドとして認識されていたCK-MMは3つ、-MBは2つに分かれる。これは血清中のカルボキシペプチダーゼによるpost-syntheticな修飾であり、このアイソフォームの分析を行うことにより組織から逸脱してからの時間が推測できる。
6)解釈上のpit fall:
・生理的変動因子:CKは筋肉内の存在するため、筋肉運動や筋肉内注射で上昇する。これらの上昇幅には個人差、薬剤差があるが、上昇するアイソザイムはCK-MMであり、アイソザイム分析を行うことにより診断価値は高まる
・新生児:新生児では体液量や運動などのためか成人と比較して高値である。特に分娩直後は高値である。しかもCK-MB、CK-BBも出現・増加している。
・測定法:現在行われているのは紫外部吸光法であり、血中のアデニレートキナーゼ(ミオキナーゼ)が2ADP→ATP+AMPを触媒するために溶血検体では偽高値となる。特にCK-M活性だけを阻害し、CK-B活性を測定してアイソザイム分析を行う免疫阻害法では正常値が20IU/l程度と低値であるので、注意する必要がある。
設問番号:CH0081
[問題]ASTのアイソザイムについて述べよ。
[解答欄]
模範解答:CH0081
[問題]ASTのアイソザイムについて述べよ。
[解答]
1)ASTの概略:アスパラギン酸・α-ケトグルタル酸とグルタミン酸・オキサロ酢酸との間のアミノ基転移を行う酵素で、心筋の他、肝臓、骨格筋、腎臓、膵臓、脾臓など多くの組織に分布している。
2)ASTアイソザイム:細胞内局在の異なるアイソザイムが知られ、細胞質上清分画に存在するs-ASTとミトコンドリア分画に存在するm-ASTである。s-ASTは分子量が約120kD、m-ASTは100kDであり、臨床検査では通常抗原性の違いを利用した免疫学的方法で測定されている。
3)臨床的意義:
・肝疾患:急性肝炎の極期ではm-ASTは1000IU/l以上で、m-AST/s-ASTが30%以上となることもある。慢性肝炎の活動期ではm-ASTが上昇することが多いが、肝硬変では低値の場合が多い。血中半減期はs-AST:14-20時間、m-AST:10時間であり、m-ASTが半減期に近い速度で減少し始めた時点で、高度の肝損傷はピークを過ぎたと判断する。また、m-ASTは劇症肝炎の重症度と比例し、アルコール肝炎ではγ-GTより鋭敏な指標ともいわれる。
・心筋梗塞:典型的な心筋梗塞では発症後6~12時間で上昇し始め、20時間前後で極値となる。重症だとm-ASTが出現する。
・骨格筋疾患:進行性筋ジストロフィ、皮膚筋炎、多発性筋炎で上昇する。
4)特殊なAST:免疫グロブリン結合ASTが他の酵素と同様同定されている。
5)解釈上のpit fall:
・溶血:赤血球中には血清と比較して80倍であり、溶血では多少高値となる。
・測定法:PLP(pyridoxyal phosphate)を補酵素とするビタミンB6酵素であり、補酵素と結合していない酵素(アポ酵素)は活性を示さない。このため、肝癌やビタミンB6欠乏状態(大酒家やINH、D-ペニシラミン服用者)ではPLP無添加試薬では低値となる。
- 事務局
-
〒101-0027
東京都千代田区神田平河町1番地
アクセスマップ
第3東ビル908号 -
TEL 03-3864-0804
FAX 03-5823-4110
E-mail:[email protected]
